Ein Chloratom kann ein Wasserstoffatom binden. Chlor ist einwertig.
Die Oxidationszahl für Chlor ist hier - I, für Wasserstoff + I
Die Oxidationszahl des Sauerstoffs beträgt hier - II ( Für Wasserstoff wieder + I
Das Bindungsvermögen der Atome: Stöchiometrische Wertigkeit (Valenz) und Oxidationszahl
Um chemische Formeln aufstellen zu können, muß man das Bindungsvermögen der Elemente beachten:
Die stöchiometrische Wertigkeit (Valenz) eines Elementes gibt dabei an, wieviel Wasserstoffatome ein Atom eines Elements binden oder ersetzen kann. Wasserstoff ist 1-wertig.
Die Oxidationszahl berücksichtigt auch, welche Ladung dadurch das Atom - formal durch Zuordnung von Elektronen in einer Elektronenpaarbindung oder als konkret vorliegende Ionenladung.
Während die Wertigkeit eine Art Elementeigenschaft darstellt kann eine Oxidationszahl nur dann angegeben werden, wenn das Atom tatsächlich gebunden ist; es kann allenfalls angegeben werden, in welchen Oxidationsstufen ein Atom auftreten kann.
Beispiele:
|
Ein Chloratom kann ein Wasserstoffatom binden. Chlor ist einwertig. Die Oxidationszahl für Chlor ist hier - I, für Wasserstoff + I |
|
| Ein
Sauerstoffatom O kann zwei Wasserstoffatome H binden. Also ist
Sauerstoff 2-wertig.Ein Sauerstoffatom ist bis auf wenige Ausnahmen immer 2-wertig. Die Oxidationszahl des Sauerstoffs beträgt hier - II ( Für Wasserstoff wieder + I |
) |
| Ein Natriumatom Na kann ein Wasserstoffatom ersetzen. Also ist Natrium 1-wertig. Natrium ist immer 1-wertig. Die Oxidationszahl ist + I. |
Bindefähigkeit
|
Wertigkeit |
einwertig |
zweiwertig |
dreiwertig |
vierwertig |
|
Molekül |
|
|
|
|
| |
|
|
|
|
|
Formel: |
HCl |
H2O |
NH3 |
CH4 |
|
Atomzahlen- |
1:1 |
2:1 |
1:3 |
1:4 |
d.h. ein zweiwertiges Atom kann zwei einwertige oder ein zweiwertiges binden oder ersetzen.
Cl - Mg - Cl oder Mg = O
ein vierwertiges Atom kann vier einwertige oder zwei zweiwertige Atome binden oder ersetzen:
CCl4 oder CO2 entspr. O=C=O
Für die Wertigkeiten ergeben sich so oft die umgekehrten Werte wie für die Atomzahlenverhältnisse: Daraus ergibt sich die "Kreuzregel":
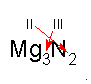 bzw
bzw 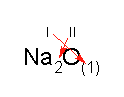
Bei den Atomzahlenverhältnissen kann natürlich gekürzt werden, während die Wertigkeit eine unabänderliche Stoffeigenschaft ist. So ergibt sich aus den jeweils zweiwertigen Atomen Mg und O die Verbindung MgO und aus dem vierwertigen Kohlenstoff und dem zweiwertigen Sauerstoff das Kohlenstoffdioxid CO2
Wertigkeiten wichtiger Elemente:
Einwertig sind die Alkalimetalle (Li, Na, K), die Halogene (Cl, Br, J), Wasserstoff und Silber
Zweiwertig sind die meisten Schwermetalle (z.B. Cu, Zn), die Erdalkalimetalle (Mg, Ca), Schwefel S und Sauerstoff O.
Dreiwertig sind Aluminium Al, einige Schwermetalle (Fe, Cr), Stickstoff N und Phosphor P.
Vierwertig sind Kohlenstoff C und Silicium Si.
Viele Schwermetalle
und Nichtmetalle können auch in mehreren Wertigkeiten auftreten, z.B.
Phosphor
(3,5), Eisen (2,3) Blei (2,4), Stickstoff (3,5) und Schwefel (2,4 und
6).