
Salpetersäure entsteht aus Oxiden des Stickstoffs, Wasser und Sauerstoff. Die Stickstoffoxide NO und NO2 bilden sich auch natürlich aus Stickstoff und Sauerstoff durch Blitze und elektrische Entladungen.
N2 + O2 → 2 NO
Im Experiment lassen sich die Stickstoffoxide durch einen elektrischen Lichtbogen ("Luftverbrennung") erzeugen:

Modellversuch zur "Luftverbrennung"
Durch Reaktion mit Wasser und Sauerstoff entsteht dann Salpetersäure HNO3 (Saurer Regen"!).
Wegen der geringen Ausbeute bzw. des zu hohen Energieverbrauchs dieses Verfahrens wird Stickstoffoxid heute technisch durch Ammoniakverbrennung mit dem Kontaktverfahren an Platin-Rhodium-Netzen hergestellt
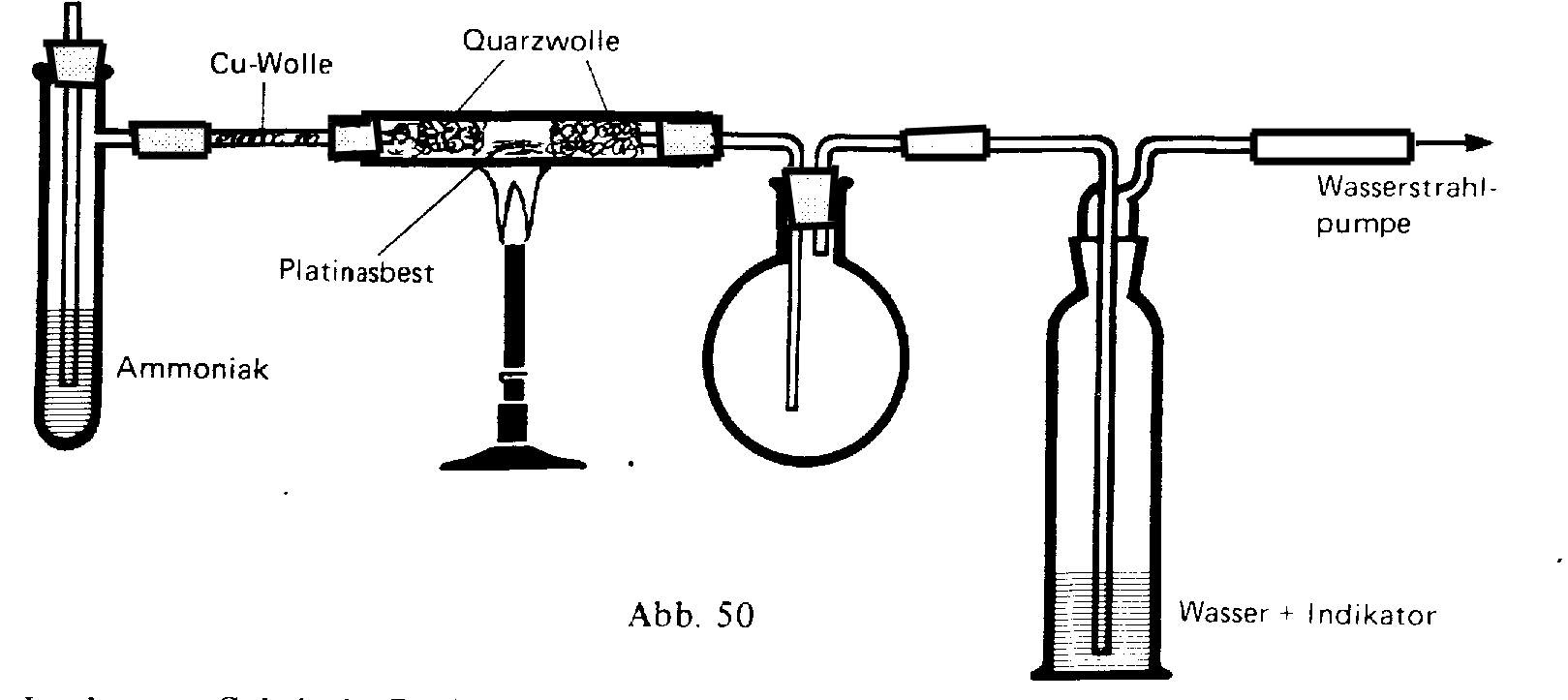
Modellversuch zur Ammoniakverbrennung
4 NH3 + 5 O2 → 4 NO + 6 H2O
Stickstoffmonoxid reagiert mit weiterem Sauerstoff zu Stickstoffdioxid., das dann zusammen mit Sauerstoff in Wasser eingeleitet wird. Dabei bildet sich Salpetersäure
4 NO + 2 O2 → 4 NO2
4 NO2 + 2 H2O + O2 → 4 HNO3
Die so erzeugte Salpetersäure ist ca. 50 - 70%ig. Sie kann z.B. zur Herstellung von Düngemitteln eingesetzt werden.
Konzentrierte Salpetersäure ist instabil und wirkt stark oxidierend. Mit brennbaren Stoffen wie z.B. Terpentinöl reagiert sie explosionsartig Mit Metallen, auch Halbedelmetallen wie Silber und Kupfer, reagiert sie unter Freisetzung von Stickstoffdioxid NO2. (Scheidewasser!). Halbkonzentrierte Salpetersäure setzt Stickstoffmonoxid frei.
Gold und Platin werden von Salpetersäure nicht angegriffen aber von "Königswasser", einem Gemisch aus drei Teilen Salzsäure und einem Teil Salpetersäure. Das hierin frei gestzte Chlor löst auch den "König der Metalle", das Gold.
Salpetersäure ist äußerst aggressiv und ätzend. Auf der Haut bildet sie gelbe Flecken (Xanthoproteinreaktion mit Eiweiß). Sie ist ähnlich stark sauer wie Salzsäure.