

Säuren sind chemische Verbindungen, in denen
Wasserstoffatome polar gebunden sind, so daß sie in
wäßriger Lösung oder anderen polaren
Lösungsmitteln mehr oder weniger in positiv
geladene
Wasserstoffionen (Protonen) und einen negativ geladenen Säurerest
dissoziieren.
In Lösungen wirken Säuren daher als Elektrolyten,
während sie
im Reinzustand meist Isolatoren sind.
Die Stärke einer gelösten Säure
ist durch ihren Dissoziationsgrad bestimmt, sehr starke Säuren
sind in verdünnten Lösungen fast vollständig
dissoziiert. Die dissoziierten Protonen lagern sich
dabei an die Moleküle des Lösungsmittels an, in Wasser werden
z. 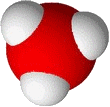 B. Hydroniumionen, H3O+ (links),
gebildet, in flüssigem Ammoniak entstehen Ammoniumionen, NH4+
(rechts).
B. Hydroniumionen, H3O+ (links),
gebildet, in flüssigem Ammoniak entstehen Ammoniumionen, NH4+
(rechts). 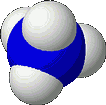
Freie Protonen existieren in Lösungen nicht. Die Hydroniumionen in wäßrigen Lösungen sind die Ursachen der sauren Eigenschaften von Säuren, z. B. dem mehr oder weniger sauren Geschmack oder der Rotfärbung von blauem Lackmuspapier. Viele Säuren können Metalle unter Wasserstoffentwicklung oder Metallhydroxide bzw. -oxide unter Wasserentwicklung lösen, dabei entstehen Salze . Mit Basen entstehen durch Neutralisation ebenfalls Salze.
|
|
Animation zur Dissoziation von Chlorwasserstoff |
Die Säuren lassen sich nach verschiedenen Gesichtspunkten untergliedern: Die zwei größten Gruppen umfassen die anorganischen Säuren mit den Mineralsäuren als Hauptvertreter und die organischen Säuren mit den Carbonsäuren. Daneben lassen sich die Säuren nach der Anzahl der Wasserstoffatome im Molekül einteilen in einprotonige, zweiprotonige, dreiprotonige usw. Säuren. Einprotonige Säuren können nur eine Salzreihe bilden; so leiten sich von der einprotonigen Salpetersäure HNO3 nur die neutralen Nitrate ab; mehrprotonige Säuren können mehrere Salzreihen bilden; so existieren von der dreiprotonigen ortho-Phosphorsäure H3PO4 drei Salzreihen, die Monohydrogen-, die Dihydrogen- und die neutralen Phosphate.
Nach dem Aufbau ihres Anions lassen sich die im Chemieunterricht verwendeten Säuren einteilen in die reinen Wasserstoffsäuren, die nur aus Wasserstoff und einem weiteren Element aufgebaut sind, wie die Halogenwasserstoffsäuren, HF, HCl , HJ, HBr, und in Oxosäuren, dh. Sauerstoffsäuren.
Eine weitere Einteilung ist die in oxidierende und nichtoxidierende Säuren. Nichtoxidierende Säuren können nur unedle Metalle wie Zink, Eisen, Aluminium u. a. unter Wasserstoffentwicklung angreifen; die oxidierenden Säuren lösen auch Halbedelmetalle wie Kupfer und Silber auf, da diese zunächst zu Oxiden oxidiert und diese Oxide anschließend zu Salzen gelöst werden.