Carbonate entstehen bei der Reaktion von Kohlensäure mit Metallen oder Metalloxiden.
Mg + H2CO3 → MgCO3 + H2
Carbonate sind in der Natur außerordentlich häufig. Sie sind uns meist unter ihren Trivialnamen bekannt:
Verbindung |
Formel |
Trivialname(n) |
Vorkommen, Anwendung |
Calciumcarbonat |
CaCO3 |
Kalkstein, Graukalk, Dolomit, Kalkspat, Marmor usw. |
Mineralien, Steine, Fels (Dolomiten!!), Baustoff |
Natriumcarbonat |
Na2CO3 |
Soda |
Wasch- und Maschinenspülmittel |
Natriumhydrogencarbonat |
NaHCO3 |
Natron, Natriumbicarbonat |
mildes Entsäuerungsmittel, Bestandteil von Back- und Brausepulver |
Kaliumcarbonat |
K2CO3 |
Pottasche |
in Holzasche enthalten, Backtriebmittel (Lebkuchen) |
Ammoniumhydrogencarbonat |
NH4HCO3 |
Hirschhornsalz |
Backtriebmittel |
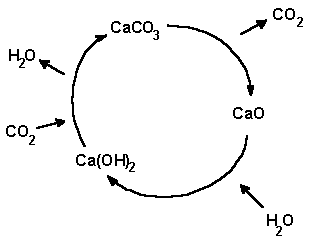
Überrragende Bedeutung hat das Calciumcarbonat als Grundstoff der Kalkbaustoffe. Beim Erhitzen (Brennen) gibt er Kohlenstoffdioxid ab und wandelt sich in Calciumoxid ("gebrannter Kalk") um, einen wichtigen Baustoff z.B. zur Herstellung von offenporigen Kalkputzen.
CaCO3 → CaO + CO2
Bei Zugabe von Wasser ("Löschen") ensteht unter hoher Energieabgabe Calciumhydroxid ("gelöschter Kalk"), der in Säcken auf allen Baustellen zu finden ist.
CaO + H2O → Ca(OH)2
Beim "Abbinden" schließlich nimmt der Kalkbrei Kohlenstoffdioxid aus der Luft auf und gibt Wasser ("Schwitzwasser") ab. Neubauten sind deshalb noch Monate nach der Fertigstellung feucht und neigen zur Schimmelbildung.
Ca(OH)2 + CO2 → CaCO3 + H2O
Am Ende des Prozesses steht also das gleiche Produkt wie am Anfang, Calciumcarbonat. Man spricht deshalb vom "Kreislauf des Kalks".

Leitet man Kohlenstoffdioxid in Kalkwasser (Calciumhydroxid-Lösung) ein so entsteht eine Trübung durch schwer lösliches Calciumcarbonat.
Ca(OH)2 + CO2 → CaCO3 + H2O
Leitet man jedoch größere Menge Kohlenstoffdioxid ein, so löst sich der Niederschlag wieder auf! Beim Erhitzen der Lösung trübt sich diese und es entstehen Kalkränder und eine Kalkschicht am Boden. Bei Zugabe einer Säure lsöt sich diese wieder auf.
Was ist geschehen?
Calciumcarbonat bildet mit Kohlensäure ein Hydrogensalz, das Calciumhydrogencarbonat:
CaCO3 + H2O + CO2 → Ca(HCO3)2
Dieses ist verantwortlich für die (temporäre) "Wasserhärte". Hartes Wasser schmeckt unangenehm, verbraucht mehr Waschmittel, verursacht auf der Wäsche einen Grauschleier und setzt vor allem Warmwasserrohre zu: Calciumhydogencarbonat zersetzt sich nämlich beim Erhitzen, aber auch spontan, wieder in schwer lösliches Calciumcarbonat, Wasser und Kohlenstoffdioxid.
Übrigens: so entstehen auch Tropfsteinhöhlen! Zuerst wäscht Kohlensäure haltiges Wasser aus dem Boden Kalk heraus. Auch in den entstandenen Höhlen ensteht aus dem gelösten Calciumhydrogencarbonat wieder Calciumcarbonat und Kohlensäure!